Hamma jismlar, shu jumladan, o’zimiz ham atomlar deb ataluvchi juda mayda «g’ishtchalar» dan iborat. Tabiatda ximiyaviy elementlar qancha bo’lsa, bunday «g’ishtchalar» tiplari ham shuncha bo’ladi. Ximiyaviy element-ayni bir tipdagi atomlar to’plami.
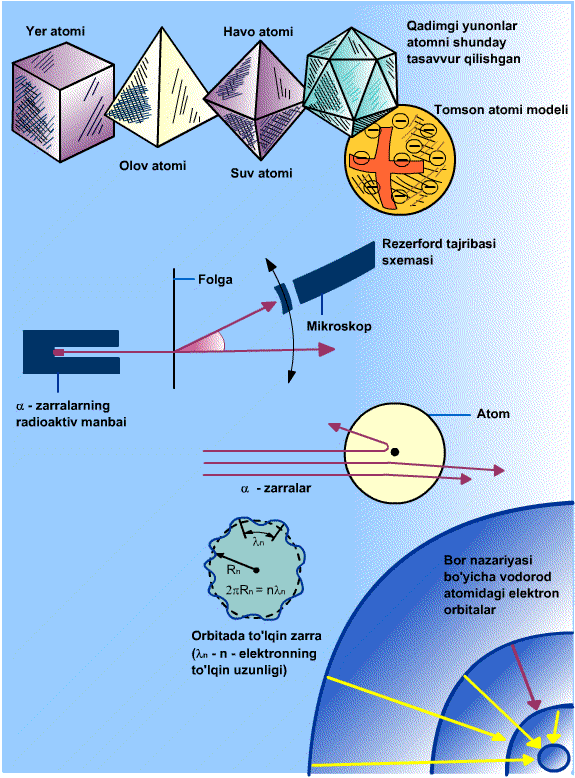
Modda juda mayda «zarrachalar»dan tuzilganligi haqidagi fikr qadimgi yunon olimlari tomonidanoq aytilgan edi. Ular ana shu zarrachalarni atomlar deb atashdi (yunoncha «atom» so’zi «bo’linmas» degan ma’noni anglatadi). Qadimgi yunonlar atomlar muntazam ko’pyoqliklar shakliga ega, deb faraz qilganlar: kub («er atomlari»), tetraedr («olov atomlari»), oktaedr («havo atomlari»), ikosaedr («suv atomlari»). Moddaning atomlaridan tuzilganligi g’oyasining eksperimental isboti olingunga qadar yigirma asrdan ortiq davr o’tdi. Bu g’oya fanda ximiya va kinetik nazariyaning yutuqlari tufayli XIX asrning ikiknchi yarmida qat’iy qaror topdi. XX asr boshiga kelib, fiziklar atomlarning o’lchamlari 10-10 m va massasi 10-27> kg atrofida bo’lishini bilar edilar. Bu vaqtga kelib atomlar umuman «bo’linmas» emas, ular ma’lum ichki tuzilishga ega, buni bilish esa D.I. Mendeleyev aniqlagan ximyaviy elementlar xossalarining davriyligini tushuntirishga imkon berishi aniq bo’lib qoldi (Kimyoviy elementlar davriy jadvali)
Elektron kashf etilgandan bir oz vaqt o’tganidan keyin, 1903 yilda ingliz fizigi Jozef Jon Tomson diametri taxminan 10-10 m, ichiga elektronlar «sochilgan» hajmi bo’yicha musbat zaryadlangan sfera shaklidagi atom modelini taklif etdi. Elektronlarning manfiy zaryadlari yig’indisi sferaning musbat zaryadi bilan kompensatsiyalanadi. Elektronlar sfera markaziga nisbatan tebranganda, atom yorug’lik nurlantiradi. Tomson, elektronlar sfera markazi atrofida qatlam bo’lib gruppalanadi, deb hisobladi.
Tomson taklif etgan modelda atom massasi uning hajmi bo’yicha bir tekis taqsimlangan. Bunday farazning xato ekanligini tez orada ingliz fizigi Ernest Rezerford isbotladi. 1908-11 yillarda uning rahbarligida a-zarryadlar (geliy yadrolari) ning metall folgada sochilishiga oid tajribalar o’tkazilgan edi (Alfa-emirilish) α-zarra yupqa folgadan (qalinligi 1 mki) o’tib va oltingugurtli qo’rg’oshindan qilingan ekranga tushib, mikroskopda yaxshi ko’rinadigan chaqnashni vujudga keltirar ekan. Ekranni α-zarraning dastlabki harakat yo’nalishiga har xil burchaklarda joylashtirildi va folgadan u yoki bu burchakka sochilgan zarralar soni sanaladi. Ko’pchilik zarralar folgadan bir oz og’ib o’tib ketishi aniqlanadi, biroq ayrim hollarda (taxminan 10000 dan bittasida) α-zarraning 900> dan katta burchakka og’gani kuzatildi. «Bu, agar 15 dyuymli snaryadni bir varaq papiros qog’ozga otganingizda, snaryad qog’ozdan qayta kelib, sizga tekkanidek, aql bovar qilmaydigan hol edi»-deb keyinchalik eslagan edi Rezerford. α-zarralarning sochilishiga oid tajribalar shuni yaqqol ko’rsatdiki, atomning butun massasi juda kichik hajmda-atom yadrosida to’plangan bo’lib, uning diametri atom diametridan 10000 marta kichikdir. Ko’pchilik α-zarralar og’ir yadro yonidan, unga tegib ketmasdan uchib o’tadi, biroq ba’zan α-zarra yadro bilan to’qnashadi va bunda u orqaga «sakrab ketishi» mumkin.
Rezerford tajribalari atomning yadro modelini yaratish uchun asos bo’ldi. Bu model bizning atom tuzilishi haqidagi bugungi tasavvurimizni ifodalaydi. Atom markazida atom yadrosi joylashgan (uning o’lchami 10 m) atomning qolgan hamma hajmini elektronlar «egallaydi». Yadro ichida elektron yo’q (bu 30 yillar boshida aniq bo’ldi); yadro musbat zaryadlangan protonlar va zaryadga ega bo’lmagan neytronlardan iborat. Atomdagi elektronlar soni yadrodagi protonlar soniga teng: bu mazkur ximiyaviy elementning atom nomeri (uning davriy sistemadagi tartib nomeri) dir. Elektron massasi proton yoki neytron massasidan taxminan 2000 marta kichik, shuning uchun atomning hamma massasi, yadroga to’plangan. Turli elektronlar yadro bilan turli darajada bog’langan: ularning ba’zilarini atom nisbatan oson yo’qotishi mumkin, bunda u musbat ionga aylanadi. Atom qo’shimcha elektronlarga ega bo’lib, manfiy ionga aylanadi. Elektromagnit nurlanishni, masalan, yorug’lik yutishda atom uyg’onadi. Atomning faqat ma’lum, berilgan ximiyaviy element uchun xarakterli bo’lan energiya portsiyalarini (kvantlarini) yutishi va chiqarishi mumkinligi muhimdir, gazsimon moddalar atomlarining yutish va chiqarish spektrlari alohida chiziqlarning tartiblashgan to’plamidan iborat bo’lishi bejiz emas. SHu munosabat bilan atomning aniq energetik sathlari haqida gapiriladi. Nurlanish yutilishda atom quyi sathlardan yuqoriroq sathlarga nurlanish chiqarilishda esa yuqori sathlardan quyi sathlarga o’tadi (kvant o’tishni bajaradi). Yutilayotgan (chiqarilayotgan) nurlanish kvantining energiyasi har safar ham kuzatilayotgan kvant o’tishlar sodir bo’layotgan sathlarning energiyalari ayirmasiga teng bo’ladi.
Atomning birinchi miqdoriy nazariyasini 1913 yilda daniya fizigi Nils Bor ishlab chiqdi. Bu eng oddiy atom-vodorod atomining nazariyasi edi. Bor Rezerford tajribalarining natijalaridan va o’sha vaqtlarda ma’lum bo’lgan atomlar vodorodning spektri haqidagi ma’lumotlardan foydalaniladi. U vodorod atomini quyidagi ko’rinishda tasavvur qildi: proton (atom yadrosi) atrofida aylanma orbita bo’ylab elektron harakatlanadi. Uyg’onmagan atomlar uchun orbitaning radiusi taxminan 0,5.10-10> m ni tashkil etadi. Atom uyg’onganda elektron yadrodan uzoqroqdagi orbitalarning biriga sakrab o’tadi. Mumkin bo’lgan orbitalarning radiuslari Rn=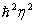 /me2 formula bilan ifodalanadi, bunda
/me2 formula bilan ifodalanadi, bunda 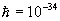 J/s-Plank doimiysi, m=9•10-31 kg-elektron massasi, e=1,6•10-19 Kl-elektron zaryadi, n-1,2,3,...-elektron orbitasining tartib nomerini ko’rsatuvchi bosh kvant soni. Har bir orbitaga elektronning ma’lum energiyasi to’g’ri keladi: En=-me4/2
J/s-Plank doimiysi, m=9•10-31 kg-elektron massasi, e=1,6•10-19 Kl-elektron zaryadi, n-1,2,3,...-elektron orbitasining tartib nomerini ko’rsatuvchi bosh kvant soni. Har bir orbitaga elektronning ma’lum energiyasi to’g’ri keladi: En=-me4/2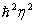 (uning manfiyligi elektronning bog’langan holatda ekanini bildiradi, nol deb erkin elektronning energiyasi qabul qilingan).
(uning manfiyligi elektronning bog’langan holatda ekanini bildiradi, nol deb erkin elektronning energiyasi qabul qilingan).
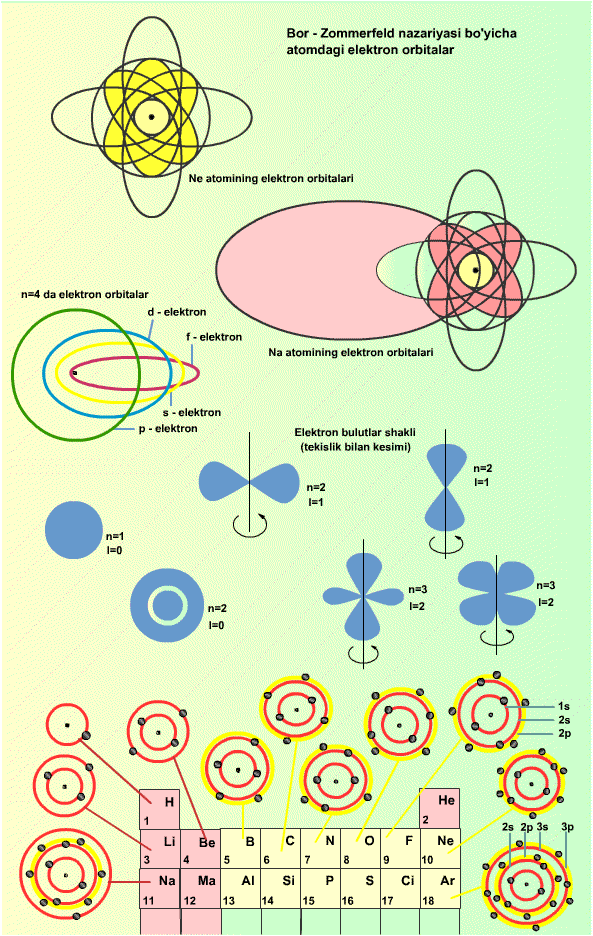
1915 yilda nemis fizigi Arnold Zommerfeld Bor nazariyasini turli atomlarga umumlashtirishga urindi. U yanada umumiyroq yondoshilganda atomdagi elektronlarning doiraviy orbitalarini elliptik orbitalar bilan almashtirish lozimligini ko’rsatdi. Elektron energiyasi asosan ellips katta yarim o’qining kattaligi bilan aniqlanadi, u esa o’z navbatida bosh kvant soni n bilan beriladi. Bunda ellipsining cho’ziqlik darajasi elektronning harakat miqdori momenti kattaligi bilan bog’langan bo’ladi. U orbital kvantsoni l bilan aniqlanadi, bu son (berilgan n kvant sonida) 0, 1, 2,..., n-1 qiymatlarni qabul qiladi. l=0 bo’lgan orbital kvant sonli elektronlar s-elektronlar deb, l=1 lisi r-elektronlar, l=2 lisi d-elektronlar, l=3 lisi f-elektronlar va hokazo deb ataladi. l ning qiymati ortgan sari elektron elliptik orbitasining cho’ziqligi kamaya boradi.
Bor-Zommerfeld nazariyasiga ko’ra, atomlar juda kichik sayyoralar sistemalariga o’xshaydi, bunda «sayyoralar» sifatida orbitalar bo’yicha markaziy jism-atom yadrosi atrofida harakatlanayotgan elektronlar ishtirok etadi. Biroq shuni nazarda tutish kerakki, sayyora sistemalari bilan o’xshashlik juda ham shartlidir. Gap shundaki, mikrodunyoda Nyuton qonunlaridan foydalanib bo’lmaydi, bu yerda kvant mexanikaning o’ziga xos qonunlariga amal qilinadi. Orbita bo’lib harakatlanayotgan elektronni, bir tomondan biror korpuskula (ma’lum massali, energiyali, zaryadli) deb, ikkinchi tomondan-uzunligi orbita uzunligida butun son marta (bu son bosh kvant soni n ning xuddi o’zginasidir) joylashadigan biror to’lqin, deb qarash mumkin. Agar n nisbatan uncha katta bo’lmasa, u holda elektron to’lqinning uzunligi orbita uzunligi tartibida bo’ladi. Bu holda elektron orbitalari haqida gapirish umuman ma’noga ega bo’lmaydi.
Kvant mexanika elektronning aniq obrazidan voz kechib, elektronni atomda fazoning elektronni topish ehtimoli ko’proq bo’lgan nuqtalarida ancha zich, o’ziga xos elektron bulut ko’rinishida tasvirlashni taklif etadi. Elektron bulutlarning shakli va effektiv o’lchamlari elektronning atomdagi holatini aniqlovchi n va l kvant sonlariga bog’liq bo’ladi.
Ko’p elektronli atomlarda elektron bulutlarning manzarasi ancha murakkab bo’lar edi. Shu munosabat bilan bulutning o’zi qaralmasdan, n va l sonlarning biror to’lami bilan tavsiflanuvchi elektronni topish mummkin bo’lgan yadrogacha masofagina qarab chiqiladi. Bu masofa elektron qobiqning radiusi deyiladi va u berilgan n va l qiymatlarni qanoatlantiradi. Agar n=1, l=0 bo’lsa, u holda 1s-qobiq haqidagapiriladi; n=2, l=0 bo’lsa, 2s-qobiq haqida, n=2, l=1 bo’lsa, 2p-qobiq haqida va hokazo haqidagapiriladi. Shuni ta’kidlab o’tish kerakki, har bir elektron qobiqqa qat’iy ravishda ma’lum sondagi elektronni «joylashtirish» mumkin. S-qobiqqa-2 ta, p-qobiqqa-6 ta, d-qobiqqa-10 ta. Bu Pauli printsipining namoyon bo’lishidir.
Elementning atom nomeri orta borgan sari elektronlar sekin-asta elektron qobiqlarini to’ldira boradi; 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p,...Masalan, litiy atomida (uyg’onmagan atom qaraladi) 1s-qobiq butunlay elektron bilan to’liq to’lgan va bundan tashqari, undan keyingi s-qobiq (2s-qobiq) da bitta elektron bor. Natriy atomida 1s, 2s, 2p qobiqlar to’liq to’lgan va 3s-qobiqda bitta elektron bor. Kaliy atomida 1s, 2s, 3p, 3s, 3p qobiqlar to’liq to’lgan va 4s-qobiqda bitta elektron bor. Ishqorli metallar atomlarning tashqi elektron qobiqlari konfiguratsiyasining bir xilligi ularning xossalari umumiy ekanini izohlaydi. Berilgan misolda atomning elektronlar joylashadigan elektron qobiqlari manzarasi kimyoviy elementlarnig davrit jadvalining qonuniyatlarini qanday qilib tushuntira olishini ko’rish mumkin.