Gaz—modda holatlaridan biri; uning zarralari o’zi kirishi mumkin bo’lgan fazoni bir tekis to’ldirib, erkin harakatlanadi. Ular bu fazoni chegaralovchi qobiqqa bosim beradi. Normal bosimda gazlarning zichligi suyuqliklarning zichligidan bir necha marta kichik bo’ladi.
Ko’pchilik gazlarning xossalari—shaffofligi, rangsizligi va yengilligi ularni o’rganishni qiyinlashtiradi; shuning uchun gazlar fizikasi va ximiyasi kech vujudga keldi va juda sekin rivojlandi. Faqat XVII asrdagina havo og’irlikka ega ekanligi isbotlangan edi (E. Torrichelli va B. Paskal) o’sha vaqtda niderland ximigi Y. Van-Gelmont havosimon moddalarni belgilash uchun gaz (yunoncha «xaos» so’zidan bo’lsa kerak) terminini kiritdi.
XIX asrning o’rtalariga kelib gazlar bo’ysunadigan asosiy tajriba qonuniyatlari belgilanadi. Ularga quyidagilar kiradi:
1) Boyl-Mariott qonuni: berilgan gaz massasi uchun o’zgarmas temperatura t da uning hajmi V bosimi r ga teskari proprotsionaldir: rV=sonst.
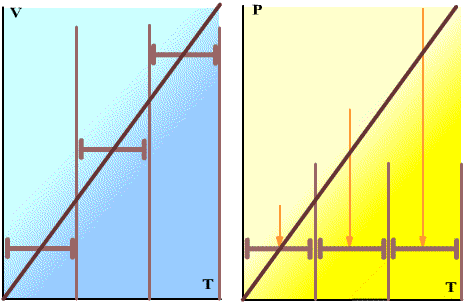
2) Gey-Lyussak qonunlari : berilgan gaz massasining bosimi o’zgarmas hajmi temperatura bilan chiziqli o’zgaradi: rt=r0 (1α+rt) ; berilgan gaz massasining hajmi o’zgarmas bosimda temperaturasi bilan chiziqli o’zgaradi: V1=V0(1α+vt).
Bu qonunlardan birinchisini fransuz fizigi J. Sharl 1787 yilda tajribada aniqlagan edi va shuning uchun uni ba’zan harl qonuni Sdeyiladi.
αr-bosimning termik koeffitsiyenti, αv –hajmiy kengayishning termik koeffitsienti deyiladi. Hamma gazlar uchun taqriban αr≈vα≈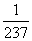 grad-1 . Shuning uchun Gey-Lyussak qonunini (masalan, hajm uchun V
grad-1 . Shuning uchun Gey-Lyussak qonunini (masalan, hajm uchun V 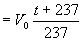 shaklda yoki kelvinda ifodalangan T=t+237 absolyut temperaturani kiritib, V=V0
shaklda yoki kelvinda ifodalangan T=t+237 absolyut temperaturani kiritib, V=V0 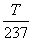 shaklda yozish mumkin.
shaklda yozish mumkin.
Avogadro qonuniga muvofiq, T=237 K da, yoki 00 C da va r=1 at da istagan gazning 1 moli V=22,41 l hajmni egallaydi. Bunday hajmdagi molekulalar soni Avogadro soni N=6,02•1023 ga teng.
Boyl-Mariott va Gey-Lyussak qonunlariga qat’iy bo’ysunuvchi gazlarni ideal gazlar deyiladi. Amalda hamma gazlar uncha yuqori bo’lmagan bosimlarda va uncha past bo’lmagan temperaturalarda o’zlarini ideal gazlardek tutadi.
3) Agar temperatura kelvinlarda ifodalangan bo’lsa, 1 mol ideal gaz uchun Boyl-Mariott tenglamasining o’ng qismi RT ga teng bo’ladi. r V=RT tenglama ideal gaz holatining tenglamasi deyiladi; u 1834 yilda fransuz fizigi va injeneri B. Klapeyron tomonidan topilgan bo’lib, 1874 yilda D. I. Mendeleyev tomonidan istagan massadagi gaz uchun umumlashtirilgan edi. Bu tenglamaga kiruvchi R doimiyni gaz doimiysi deyiladi; u 8,31 J/mol grad ga teng.
Klapeyron-Mendeleyev qonuni ham faqat ideal gazlar uchun o’rinlidir. Ular uchun yana bir qonun-Dalton qonuni bajariladi: ideal gazlar aralashmasining bosimi aralashmani tashkil etgan ayrim gazlarning partsial bosimlari yig’indisiga teng, ya’ni agar har bir gazning temperaturasi gaz aralashma hajmidagi temperaturada olinganda, har bir gaz alohida hosil qilinadigan bosimlar yig’indisiga teng bo’ladi.
Gazlarning kinetik nazariyasi gazlarda molekulalar o’zlarining o’lchamlaridan ancha katta masofada joylashgan, degan farzga asoslangan. Molekulalar orasidagi masofadan (molekullarning o’lchamidan) bir necha marta ortiq bo’lgan erkin yugurish uzunligi masofada gaz molekulalarining issiqlik harakati tekis va to’g’ri chiziqli bo’ladi. Molekula boshqa molekula bilan yoki idish devori bilan to’qnashganda bilyard sharlar to’qnashganni kabi, ya’ni elastik jismlarning urilish qonunlari bo’yicha yo’naltishini va tezligini o’zgartiradi. Ideal gaz molekulalari orasida o’zaro ta’sirlar (juda kam to’qnashishlardan tashqari) bo’lmaydi; uning energiyasi faqat temperaturaga bog’liq bo’ladi.
Kinetik nazariya gazlarning yopishqoqligi, diffuziyasi va issiqlik o’tkazuvchiligini juda yaxshilib tushuntirishga imkon beradi.
Real gazlar gazning temperaturasi, bosimi va fizik tabiatiga bog’liq holda idel gaz qonunlaridan oz yoki ko’p darajada chetlanadi. Bosim katta bo’lganda, juda bo’lmaganda, ikkita tuzatma, ya’ni molekulalar orasidagi tortishish kuchlariga va molekulalarning hajmiga tuzatma kiritish zarur. Real gazlar holatining bir necha o’nlab tenglamasi taklif etildi. Ulardan eng soddasi-Van-der-Vaals tenglamasidir: 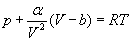 , unda a va b –gazning tabiatiga bog’liq bo’lgan, molekulalarning o’zaro ta’siriga (α) va xususiy hajmiga (β) kiritilgan tuzatmalarni harakatlovchi doimiy kattaliklar.
, unda a va b –gazning tabiatiga bog’liq bo’lgan, molekulalarning o’zaro ta’siriga (α) va xususiy hajmiga (β) kiritilgan tuzatmalarni harakatlovchi doimiy kattaliklar.