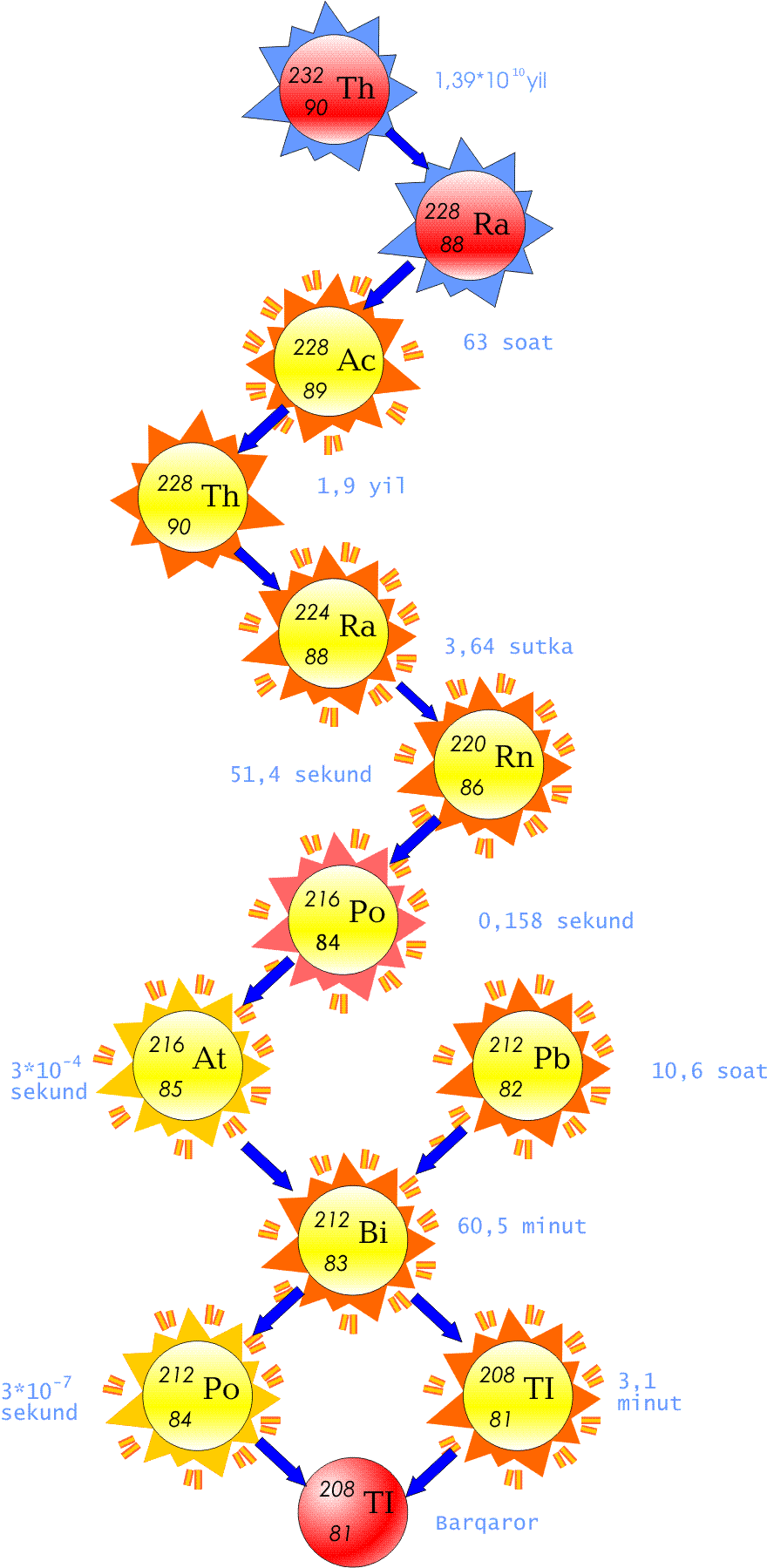
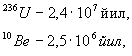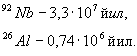Radioaktivlikni o’rganish davomida olimlar 40ga yaqin tabiiy radioaktiv moddalar kashf qilishdi. Ular radioaktiv oilalarga birlashtirilgan bo’lib, toriy va uran izotoplari bu oilalarning asoschilari hisoblanadi (rasmga qarang). Bu moddalar orasida ba’zilari, garchi massalari jixatidan faq qilsa ham, o’xshash ximiyaviy xossalarga ega edi. 1913 yilda ingliz olimi F.Soddi ularni izotoplar deb atadi; bu termin yunoncha «bir xil» va «o’rin» degan ma’noni bildiruvchi so’zlardan yaratilgan bo’lib, u biron-bir elementning davriy sistemada ayni bir o’rinni egallashi lozim bo’lgan turli atomlari ustida gap ketayotganini ta’kidlaydi.
Ko’p vaqt o’tmay, mass-spektrometriya metodi bilan tadqiqotlar o’tkazayotgan ingliz olimi F.Aston ko’pgina barqaror ximiyaviy elementlarning ham izotoplari bor ekanligini isbot qilishga muvaffaq bo’ldi.
Izotoplar-ximiyaviy elementning yadrolaridagi protonlar soni Z ning qiymati birday bo’lgan, lekin undagi neytronlar soni N jihatidan farq qiluvchi atomlarining turli xillaridir. Masalan, kislorodning (Z=8) tabiiy izotoplari yadrolarida mos ravishda 8, 9 va 10 tadan neytron bor. Izotop yadrosidagi protonlar va neytronlar sonlarining yig’indisi (Z+N) massa soni A deb ataladi. Hozir izotoplarni shunday belgilash qabul qilingan: element simvolidan chap tomonda pastga Z kattaligi, yuqoriga esa A kattaligi yoziladi: 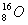 ,
, 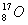 va
va 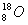 .
.
Hozirgi vaqtda 107 ximiyaviy elementning 1900 dan ortiq izotopi ma’lum. Ular ikki gruppaga ajratilishi mumkin: tabiiy izotoplar va sun’iy sintezlangan izotoplar. Tabiiy izotoplarga atomlarning barcha barqaror turlari (ular ta’minan 280ta) va radioaktivlik oilalar tarkibidagi barcha tabiiy radioaktiv atomlar (46) kiradi. Qolgan barcha izotoplar turli yadro reaksiyalari natijasida olingan. yerda uchramaydigan transuran elementlarga kiradi. Hozircha kelgusida sintez qilish imkoni bo’lgan izotoplarning umumiy soni noma’lum. Nazariyotchilarning hisoblariga qaraganda, u yoki bu usulda yashashi mumkin bo’lgan atomlar turlarining soni 6000 atrofida bo’lishi kerak (!)...
Sun’iy izotoplarning aksariyat ko’pchilik qismining yarim yemirilish davri juda kichik bo’lib, sekundlarning ulushlari yoki sekundlar bilan o’lchanadi. Ba’zi «uzoq umr ko’ruvchilari»ning mavjudligi ham ma’lum, masalan:
Ular yer boshlang’ich evolyutsiyasining ilk davrlarida ham mavjud bo’lgan bo’lishi mumkin. Bizning kunlarimizgacha «umr ko’rish» uchun tabiiy radioaktiv izotopning yarim yemirilish davri 1,5•108 yildan kam bo’lmasligi kerak. Ba’zi barqaror izotoplar ham, garchi nihoyatda sust darajada bo’lsa-da, radioaktiv bo’lib chiqdi, masalan: 40K, 87Rb, 115, 138La, 147Sm, 176Lu, 187Re. Ularning yashash davrlari shunchalik uzoqki, bu izotoplarni barqaror deyish mumkin.
Muayyan element izotoplarining ximiyaviy xossalari mutlaqo bir xil, chunki ularning elektron qobiqlari bir xil tuzilgan. Shuning uchun izotoplarni ajratish nihoyatda murakkab masaladir. Bu masalani hal qilish uchun qiyin va qimmatga tushadigan bir necha metodlar taklif qilingan va rivojlantirilgan, ular diffuziya tezligining, magnit maydonidagi harakat traektoriyasining va ba’zi boshqa fizik xossalarning yadroning massasiga bog’liqligini o’rganishga asoslangan (Diffuziya, Mass-spektrometriya). Vodorod 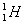 , og’ir vodorod
, og’ir vodorod 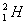 (deyteriy) va «o’ta og’ir» vodorod
(deyteriy) va «o’ta og’ir» vodorod 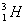 (tritiy), shuningdek geliy
(tritiy), shuningdek geliy 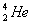 va
va 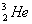 kabi (yadrolarining massalari jihatidan kuchli farq qiluvchi) izotoplar fizik xossalari jihatidan, ayniqsa kuchli farq qiladi.
kabi (yadrolarining massalari jihatidan kuchli farq qiluvchi) izotoplar fizik xossalari jihatidan, ayniqsa kuchli farq qiladi.
Fan va texnikaning ko’pgina sohalari uchun turli elementlarning izotoplari sof holda kerak bo’ladi. Shuning uchun izotoplarni ajratishning samarali metodlarini ishlab chiqish hozirgi vaqtda ham fizikaning aktual masalasi bo’lib qolmoqda.