Erish – moddaning qattiq holatdan suyuq holatga o’tishi. Bu protsess qizdirishda yuz beradi. Masalan, oson eriydigan metall – qo’rg’oshin 600 K yoki 327'S gacha qizdirilsa, qattiq holatdan suyuq holatga o’tadi. Qo’rg’oshinni zanglamaydigan po’latdan yasalgan qoshiqda gaz plitada oson eritish mumkin.
Agar qo’rg’oshinni isitayotib, hamma vaqt uning temperaturasi o’lchab turilsa, u holda biz temperaturaning dastavval o’sib borishini, ammo qizdirish davom ettirilayotganiga qaramay, biror paytdan boshlab o’zgarmay qolishini ko’ramiz. Bu payt erish boshlanganiga mos keladi. To qo’rg’oshin to’la erib bo’lmaguncha temperatura o’zgarmay qolaveradi va faqat erigandan keyingina yana ko’tarila boshlaydi. Suyuq qo’rg’oshinni sovutganda esa teskari manzara kuzatiladi: qotish boshlanishiga qadar temperatura pasayadi, to qo’rg’oshin to’la qotib bo’lmaguncha o’zgarmay qoladi va keyin yana pasayadi. Hamma toza moddalar ana shu tarzda eriydi va qotadi. Erishda temperaturaning o’zgarmasligi katta amaliy ahamiyatga ega, chunki u termometrlarni darajalash, qat’iy belgilangan temperaturada eriydigan eruvchan indikatorlar va saqlagichlar ishlab chiqarishga imkon beradi.
Erish temperaturasi va unga teng bo’lgan qotish temperaturasi moddaning xarakterli belgisidir. Mana ba’zi bir sonlar. Atmosfera bosimida sovutilganda vodorod 13 K da qotadi, simob –234 K da, suv – 273 K da, qalay – 505 K da, rux, – 692 K da, kumush – 1235 K da, temir – 1812 K da qotadi, sodda moddalar orasida uglerod (4020 K), volfram (3660 K) va reniy (3450 K) eng qiyin eruvchan moddalardir.
Erish vaqtida nimalar yuz beradi? Ravshanki, atomlar joylashishida kattiq holatda mavjud bo’ladigan tartib fazoviy kristall panjara buziladi. Kristallda atomlar o’zining muvozanat vaziyatlari atrofida tebranadi. Temperatura ko’tarilgan sari tebranishlar amplitudasi ortib boradi va muayyan kritik kattalikka yetadi, shundan keyin panjara buziladi. Bunga qo’shimcha issiqlik energiyasi kerak bo’ladi, shuning uchun erish protsessida, garchi issiqlik kelib turishi davom etaversa-da, temperatura ko’tarilmaydi. Erish uchun zarur bo’lgan issiqlik miqdoriga erish issiqligi deyiladi. Erish issiqligi kattaligi turli moddalar uchun turlichadir. Masalan, 1 kg qo’rg’oshinni eritish uchun unga 24,7 kJ issiqlik, 1 kg misni eritish uchun esa unga deyarli 10 marta ko’p, ya’ni 205,0 kJ issiqlik berish kerak.
Erish temperaturasi qaynash temperaturasiga o’xshash bosimga bog’liq bo’ladi. Eriyotganda hajmi ortadigan moddalar (bundaylar juda ko’pchilikni tashkil etadi) uchun bosim ortishi bilan erish temperaturasi ham ortadi va aksincha. Muz eriganda hosil bo’lgan suvning hajmi kichik bo’ladi (shuning uchun suv muzlayotib, trubalarni yorib yuboradi) va bosim ortganida muz pastroq temperaturada eriydi. Vismut, galliy, cho’yanning ba’zi markalari ham xuddi shunday.
Qotishda atomlar yana muayyan tartibda joylasha boshlaydi va qotish issiqligi ajraladi. Suyulmada qotish, odatda, birdaniga ko’p nuqtalarda boshlanadi. Ko’p kristall vujudga keladi va bir vaqtda o’sa boradi. Dastlab, ular bir-biriga xalaqit bermaydi, so’ngra esa to’qnasha boshlaydi. Oqibatda hosil bo’ladigan qattiq jism ko’p sonli kristallchalardan tuziladi, upolikristall bo’ladi. Suyulmadan ayrim yirik kristallar – monokristallar o’stirish metodlari mavjud.
Qotishmalar (yoki bular, ya’ni ikki moddadan iborat va ko’p komponentli sistemalar deb ham ataladi) ning erish temperaturasi erigan modda kontsentraniyasiga bog’liq bo’ladi. Qotishmalar erishini o’rganish uchun temperaturaning qizdirish yoki sovutish vaqtiga bog’liqligini ifodalovchi qizdirish va sovutish egri chiziqlari (grafiklari) yasash qulay ekan. Toza jismlar, uchun bunday egri chiziqlarda erish temperaturasida faqat gorizontal qism bo’ladi, ammo bular sistemalar uchun egri chiziqlar ancha murakkab ko’rinishda bo’ladi. Ularda, tarkibga bog’liq ravishda, gorizontal chiziqlar bilan bir qatorda kattaroq yoki kichikroq og’malikdagi qismlar, bukilishlar va h. k. paydo bo’ladi. Masalan, sovutish egri chizig’ining yo’li suyulmadan qattiq kristallchalar o’sa boshlaganida o’zgaradi. Bunday sistemalarda qattiq kristallarning tarkibi, odatda, suyulmaning tarkibi bilan bir xil bo’lmasligini ta’kidlab o’tamiz.
Qizdirish va sovutish egri chiziqlaridan foydalanib, tadqiqotchilar fazoviy muvozanat diagrammalari (Fazaviy o’zgarishlar) yoki holat diagrammalari deb ataluvchi diagrammalar yasaydilar, ularda abstsissa o’qiga vaqt emas, balki elementlar miqdori qo’yiladi.
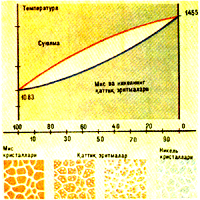
Hozirgi vaqtda bunday diagrammalar juda ko’p qotishmalar, ayniqsa, metall qotishmalar uchun yasalgan. Mis – nikel sistemasining holat diagrammasi bunga misol bo’la oladi. Mis va nikel suyuq holatda ham, qattiq holatda ham har qanday nisbatda birika oladi, qattiq holatda ular o’rin egallash tipidagi qattiq eritmani tashkil kiladi. Bu, nikel atomlari kristall panjarada hamma mis atomlari o’rnini egallashga qodir, demakdir. Misning erish temperaturasi 1083'C, nikelniki 1445'C. Mis bilan nikel qotishmalari uchun yasalgan holat diagrammasidan ko’rinishicha, ular biror muayyan temperaturada emas, balki biror temperatura intervalida eriydi va qotadi, bu intervalda qattiq metall ham, suyulma ham birga mavjud bo’ladi. Diagrammada bu interval toza mis va toza nikel erish temperaturalarini tutashtiruvchi ikki chiziq bilan chegaralangan: yuqorigi chiziq qizdirishda erishning oxirini yoki sovutishda qotishning boshlanishini, pastki chiziq tegishlicha erish boshlanishini yoki qotish oxirini belgilaydi. Shunday qilib, diagramma uch sohaga bo’linadi. Suyuq eritmaning mavjud bo’lish sohasi yuqorigi chiziqdan balandda, kristall qattiq eritmalarning mavjud bo’lish sohasi esa pastki chiziqdan pastda bo’ladi. Chiziqlar orasida suyulma va qattiq eritmaning mavjud bo’lish sohasi joylashgan. Yuqorigi chiziqni likvidus chizig’i, pastkisini esa solidus chizig’i deb ataladi (lotinchadan tarjimasi: «likvidus» – «suyuq», «solidus» – «qattiq») .
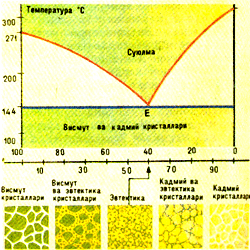
Vismut – kadmiy sistemasining holat diagrammasi butunlay boshqacha ko’rinishga ega. Bu metallar qattiq holatda biri-birida erimaydi, balki vismut kristallchalari va kadmiy kristallchalarining mexanik aralashmasini hosil qiladi. Bu sistemada suyulmaning mavjud bo’lish sohasini vismut va kadmiy erish temperaturalarini ye nuqta bilan tutashtiruvchi likvidus siniq chizig’i pastdan chegaralaydi. e nuqta 60% (massa bo’yicha) vismut va 40% kadmiydan tashkil topgan qotishmaning erish temperaturasini ko’rsatadi. Bu vismut va kadmiyning doimiy TE temperaturada eriydigan yagona qotishmasidir. Boshqa barcha qotishmalar yuqoridan likvidus chizig’i bilan, pastdan – e nuqtadan o’tuvchi solidus gorizontal chizig’i bilan chegaralangan temperatura intervalida eriydi va qotadi. Doimiy temperaturada qotadigan qotishmaga evtektik qotishma deyiladi; u kadmiy va vismutning juda mayda kristallchalaridan iborat bo’ladi.
Bu qotishmaning erish va qotish temperaturasi (1440S) toza kadmiynikidan (3210S) va vismutnikidan (2710S) ancha past bo’lishiga e’tibor bering. Bu holat estektik nuqtaga ega bo’lgan barcha sistemalar uchun xarakterlidir («evtektos» yunoncha so’z bo’lib, «oson eriydigan» deganidir). Masalan, 56,5% vismut va 43,5% qo’rg’oshindan tashkil topgan evtektik kotishma 1250S da eriydi, vaholanki, qo’rg’oshinning erish temperaturasi 3270S dir. Vud qotishmasi (50% vismut, 25% qo’rg’oshin, 12,5% dan qalay va kadmiy) 68,00S da, simobning 8,5% galliy bilan qotishmasi 600S da eriydi. Holat diagrammalari qotishmalarning tuzilishi hamda ularning qizdirish va sovutishda, erish va qotishda o’zini qanday «tutishi» to’g’risida bizga muhim ma’lumot beradi, lekin ular qotishma issiqlik muvozanati holatida bo’lganidagina haqiqatga mos keladi.
Agar barcha protsesslar juda sekin yuz bersa, shunday holat vujudga keladi.