Kinetik nazariya moddada yuz beradigan protsesslarni shu modda zarralari bajaradigan molekulyar harakatlarga asoslanib tadqiq qiladi. Uning asosiy g’oyasi shundan iboratki, moddiy jismlar uzluksiz harakatdagi mayda zarralar (atomlar, molekulalar) dan iborat. Bu g’oya qadimgi yunon faylasuflariga ham ma’lum edi. Demokrit (taxm. mil. av. 460-370) fikricha, atomlar birikib va ajralib, tabiatda cheksiz turli-tuman moddalarni hosil qiladi. Kinetik nazariyaning jadal taraqqiyoti faqat XIX asr o’rtalarida gazlar nazariyasi, issiqlik mashinalari va termodinamika rivoji bilan bog’liq ravishda boshlandi.
Kinetik nazariya protsesslarning borishini (tezligi, vaqt o’tishi bilan moddalarning xossalari o’zgarishini) ham (termodinamika bu bilan shug’ullanmaydi) issiqlik muvozanati holatini ham ifodalaydi. Bu nazariya nuqtai nazaridan muvozanat shunday holatki, bunda turli molekulyar protsesslar bir-birini muvozanatlaydi. Aytaylik, suyuqlik bilan uning to’yingan bug’i orasidagi muvozanatda (Bug’lanish) vaqt birligida bug’lanayotgan suyuqlik zarralari soni kondensiyalanayotgan bug’ zarralari soniga teng bo’lishi lozim.
Gazlarning kinetik nazariyasi eng dastlabki va rivojlangan nazariya hisoblanadi. R. Klauzius (1822-1888), J. Maksvell (1831-1879) va L. Bolsman (1844-1906) unga asosiy hissa qo’shdilar. Molekulalarni mutlaqo qattiq, elastik sharchalar, deb tasavvur qilish gazlarning kinetik nazariyasi rivojida katta rol o’ynadi.
Kinetik nazariyaga ko’ra, gazda zarralar (atomlar, molekulalar) bir-biridan o’z o’lchamlariga nisbatan katta masofada turadi, ba’zan bir-biriga va idish devorlariga urilgan holda to’g’ri chiziqli va tekis harakatlanadi. Molekulalarning idish devorlariga urilishi gaz bosimini vujudga keltiradi. Gaz molekulalarining erkin (izchil to’qnashishlar orasidagi) harakati uzunligi haqidagi tasavvurni nemis fizigi R. Klauzius kiritdi, u gaz bosimini ham birinchi bo’lib hisobladi. Gaz bosimi hajm birligidagi molekulalar soniga va ularning kinetik energiyasi o’rtacha qiymatiga proportsional. Gaz molekulalarining tezlik bo’yicha boshlang’ich holatlari qanday bo’lishidan qat’iy nazar, to’qnashishlar natijasida ba’zi zarralarning tezligi oshadi, ba’zilariniki kamayadi, oqibat natijada Maksvell taqsimoti vujudga keladi. Ma’lumki, bunda gaz molekulalari barcha tezliklarga (eng kichik tezlikdan to eng katta tezlikkacha) ega bo’ladi, lekin tezlikning o’rtacha kvadrati (ya’ni barcha molekulalar tezliklari kvadratlari yig’indisining molekulalar soniga bo’lingani) faqat gazning absolyut temperaturasi T va molekulalar massasi m ga bog’liq: < v2>=3•k•T/m bunda k- Boltsman doimiysi (1,38•10-10J/K) <> qavslar bilan o’rtacha qiymat ifodalangan. Aytaylik, 300 K da u kislorod uchun < v2>=2,42•105m2/s2 bu sonning kvadrat ildizi (kislorod molekulasining o’rtacha kvadratik tezligi) 492m/s ni tashkil qiladi. Molekulaning o’rtacha kinetik energiyasi 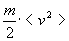 va, demak, 3/2•k•T ga teng, ya’ni absolyut temperaturaga proportsional.
va, demak, 3/2•k•T ga teng, ya’ni absolyut temperaturaga proportsional.
O’sha temperaturada vodorod molekulasining o’rtacha kvadratik tezligi 2000m/s atrofida bo’ladi. Shunday qilib, gaz molekulalari tezligi, masalan, artilleriya snaryadlari tezligidan katta, lekin molekulalar ancha sekin siljiydi. Tajribadan ma’lumki, atirning hidi xonaning bir burchagidan ikkinchi burchagiga bir necha o’n sekundda boradi. Bunday sekinlikka sabab shuki, gaz molekulalari to’g’ri chiziq bo’yicha emas, balki boshqa molekulalar bilan to’qnashishi tufayli harakat yo’nalishini bir necha marta o’zgartirib, murakkab trayektoriya bo’yicha harakatlanadi (Broun harakati, Diffuziya).
Gaz zarralari orasidagn to’qnashishlar relaksatsion protsesslar uchun juda muhim. Bir xil bosim sharoitida gazni issiqlik muvozanatiga yaqinlashtiruvchi protsesslar relaksatsion protsesslar deb ataladi. Bunga diffuziya (har xil gazlarning aralashishi), issiqlik o’tkazuvchanlik (temperaturalarning tenglashishi) va yopishqoqlik (yoki ichki ishqalanish) protsesslari kiradi. Bular qo’zg’almas idishda yaxlit gaz harakatining to’xtashida namoyon bo’ladi. Kinetik nazariya bu protsesslarning tezligini hisoblashga imkon beradi.
XX asr boshida gazlarning kinetik nazariyasidan keyin qattiq jismlarning kinetik nazariyasi rivojlandi. Qattiq jismlarda atomlar (yoki ionlar) bir-biriga juda yaqin va hamma yerda bir xil joylashib, to’g’ri kristall panjarani hosil qiladi. Odatda, atomlararo masofa nanometrning bir necha o’nlarcha ulushini tashkil etadi. Bunda issiqlik harakati har qaysi atomning kristall panjara tugunida muvozanat holat atrofida kichik tebranishlaridan iborat bo’ladi. Tebranish amplitudasi, odatda, atomlararo masofaning bir necha protsessini tashkil qiladi. A. Eynshteyn va P. Debay bu manzarani turlicha soddalashtirib, qattiq jismlarning issiqlik sig’imini hisoblashga erishdilar. Xususan, Eynshteyn yuqori temperaturalarda barcha atomlar bir xil chastotada tebranishini va ularning hammasi mustaqil tebranishini taxmin qilgan.
Atomlarning bir xilda tebranmasligini hisobga olish shunga olib keladiki, past temperaturalarda qattiq jismlarning issiqlik sig’imi absolyut temperatura kubiga proporsional (Debay nazariyasi) va temperatura nolga intilganda u ham nolga intiladi (Nernst teoremasi, termodinamikaning uchinchi qonuni). Real qattiq jism xossalarining Guk qonuniga bo’ysunadigan ideal elastik jismlar xossalaridan farqlarini hisobga olish har xil tebranishlar orasida energiyaning qayta taqsimlanishi bilan bog’liq bo’lgan qattiq jismlardagi relaksatsion protsesslar nazariyasini yaratishga, qattiq jismlarning issiqlikdan kengayishini tushuntirishga imkon berdi.
Qattiq jismlardagi diffuziyani to’g’ri ifodalashga olim Y. I. Frenkel ilgari surgan, kristall panjarada bo’sh tugunlar - vakansiyalar mavjudligi, temperatura ortishi bilan ularning soni keskin ko’payishi haqidagi tasavvurlar katta rol o’ynadi.
Suyuqliklarning kinetik nazariyasini ishlab chiqishni ham 1924 yilda Y. I. Frenkel boshlab berdi. U suyuq holat bilan qattiq holat o’rtasidagi o’xshashlikdan kelib chiqdi. Frenkelning fikricha, suyuqlikdagi molekulalarning issiqlik harakati, xuddi qattiq jismdagi kabi muvozanat holat atrofidagi kichik tebranishlardan iborat, lekin muvozanat holatning o’zi, kristalldan farqli ravishda, vaqti-vaqti bilan atomlar orasidagi masofachalik oraliqda sakrashsimon siljib turadi. Shunga asoslanib, suyuqliklarning asosiy xossasi - oquvchanlik yoki yopishqoqlikni tadqiq qilishga va temperatura ortishi bilan yopishqoqlik kamayishini tushuntirishga imkon tug’ildi.
Kinetik nazariyaning eng muhim sohalaridan biri ximiyaviy reaksiyalar kinetikasi bo’lib, u reaksiyalar tezligini temperatura, bosim va boshqa omillarga bog’liq ravishda hisoblashga imkon beradi. Har qanday ximiyaviy reaksiya reaksiyada ishtirok etadigan dastlabki moddaga mos shakldagi zarralardan tortib, to reaksiya mahsuliga mos shakldagi zarralarning qayta gruppalanishidan iborat. Bunday qayta gruppalanish ma’lum energiyani talab qiladi va u aktivlash energiyasi deb ataladi. Temperatura ortishi bilan ximiyaviy reaksiyalar tezligi ham ortadi, aktivlash energiyasi qanchalik katta bo’lsa, reaksiya shunchalik ko’proq tezlashadi. Kinetik nazariya atomlarning qayta gruppalanishidagi har bir elementar akt boshqasiga bog’liq bo’lmagan ximiyaviy reaksiyalarni ham, bir elementar aktning amalga oshishi yana bir yoki bir necha elementar aktlarni keltirib chiqaradigan ximiyaviy reaksiyalarni ham o’rganadi. Ikkinchi tip reaksiyalar zanjir reaksiyalar deb ataladi. Yorug’lik ta’sirida, yuz beradigan fotoximiyaviy reaksiyalar, yonish, polimerlanish reaksiyalari va h.k. ana shular jumlasiga kiradi.