Italyan fizigi va ximigi Amedeo Avogadro (1776-1856) Turin shahrida tug’ilgan. U yuridik ma’lumot oldi. Biroq tabiiy fanlarga qiziqishi va moyilligi uni fizika va matematikani mustaqil o’rganishga undadi. 1806 yildan u Turindagi universitet litseyida fizikadan dars bera boshladi. 1830 yilda esa Turin universitetining matematik fizikadan professori bo’ldi.
Avogadroning ilmiy ishlari fizika va ximiyaning turli sohalariga bag’ishlangan. 1811 yilda o’zining oddiy gazlarning molekulalari bitta yoki bir nechta atomdan tashkil topgan, degan gipotezasini olg’a surdi. Shu asosda u ideal gazlarning asosiy qonunlaridan birini ta’rifladi, bu qonun Avogadro qonuni deb nom oldi. Bu qonun shunday ta’riflanadi: «Teng hajmdagi istagan gazdan bir xil sharoitda molekulalar soni bir xil bo’ladi». (Bir xil sharoit deganda bir xil temperatura va bosim nazarda tutiladi). Avogadro qonuni keyinchalik atom-molekulyar ta’limotni rivojlantirgan asoslardan biri bo’ladi.
Bu qonundan gazlarning bir xil tashqi sharoitda o’lchangan zichliklari nisbati ularning molyar massalari nisbati kabi bo’lishi kelib chiqadi. Agar biror gazning molyar massasini birlik uchun qabul qilsak (odatda, uglerodning 1/12 mol massasi), gazlarning zichliklarini bilgan holda ularning nisbiy molyar massalarini hisoblab topish mumkin.
Keyinchalik fizik ximiya asoschilaridan biri-niderland olimi Y. Vant-Goff quyidagi o’xshashlikka asoslanib, ideal gaz qonunlarini suyultirilgan eritmalarga tatbiq qildi: «Gaz bo’sh fazoda butun hajmni egallab tarqalgani singari, eritilgan modda eritkichning butun hajmi bo’yicha tarqaladi».
Vant-Goff gaz o’zi joylashgan idishning devorlariga bosim bergani kabi, eritilgan modda ham o’ziga xos bosim hosil qilishini ko’rsatdi; bu bosimni u osmotik bosim deb atadi. Osmotik bosim biz eritkichni olib tashlab, eritilgan modda o’shanday hajmni gaz shaklida to’ldirganda kuzatilishi mumkin bo’lgan gaz bosimiga tengdir. Shunday qilib, biror eritkichdagi ma’lum bir moddaning osmotik bosimini o’lchab, bu moddaning gazsimon holatidagi zichligini bilish va Avogadro qonuni yordamida uning molekulyar massasini hisoblash mumkin. Shu tarzda gazsimon holatida hosil qilish qiyin yoki mumkin bo’lmagan moddalarning, masalan, qandning molekulyar massasini aniqlash mumkin bo’ladi.
0,012 kg uglerodda nechta atom bo’lsa, shuncha molekulaga ega bo’lgan mazkur modda miqdori mol deyiladi. Bu holda Avogadro qonunini bunday ta’riflash ham mumkin: «Istagan moddaning bir moli tarkibida ayni bir xil sondagi molekulalar bo’ladi». Bu son Avogadro soni deb nom oldi. U 6,02•1023 mol-1 ga teng. Avogadro soni turli usullar bilan aniqlanadi, ularning ba’zilari broun harakatini o’rganishga asoslangan. Avogadro qonunining ikkinchi ta’rifi faqat gazlar uchungina emas, balki suyuqlik va qattiq jismlar uchun ham o’rinlidir.
Avogadro sonini bilish mikrodunyoning ko’lami, molekulalarning
o’lchamlari haqida tasavvur beradi. 1 sm3 suvni olaylik;
uning massasi 1 g, u suvning 1/18 moliga teng; demak, 1 sm3
suvda 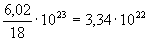 suv
molekulasi bor ekan. Binobarin, bir molekulaning hajmi
suv
molekulasi bor ekan. Binobarin, bir molekulaning hajmi
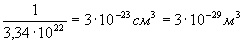 . Suyuqlikda
molekulalar zich joylashgan deb hisoblansa, molekulaning chiziqli
o’lchami, ya’ni hajmining kub ildizdan chiqarilgan kattaligi taxminan
3•1010-10s m yoki 0,3 nm ga teng bo’ladi.
. Suyuqlikda
molekulalar zich joylashgan deb hisoblansa, molekulaning chiziqli
o’lchami, ya’ni hajmining kub ildizdan chiqarilgan kattaligi taxminan
3•1010-10s m yoki 0,3 nm ga teng bo’ladi.
Boshqa atom va molekulalarning chiziqli o’lchamlari ham nanometrning o’ndan bir necha ulushlari tarkibidagi kattaliklardir. Optik mikroskopda kuzatish mumkin bo’lgan eng kichik zarrachalar mikrometrning o’ndan bir necha ulushiga teng o’lchamlarga ega bo’ladi, ya’ni ularda taxminan 10 mlrd. atom bor. Biroq elektron mikroskop va boshqa ba’zi asboblar (masalan, ionli proyektor) yordamida yakka atomlarni kuzatish mumkin.