Jismning issiqlik sig’imi deb, shu jism temperaturasini bir gradusga ko’tarish uchun unga berish lozim bo’lgan issiqlik miqdoriga aytiladi. Jism bir gradusga soviganda, u shuncha miqdordagi issiqlikni beradi. Issiqlik sig’imi jism massasiga proporsional. Jism massa birligining issiqlik sig’imi solishtirma issiqlik sig’imi, solishtirma issiqlik sig’imining atom yoki molekula massasiga ko’paytmasi tegishlicha atom yoki molyar issiqlik sig’imi deyiladi.
Turli moddalarning issiqlik sig’imlari bir-biridan kuchli farq qiladi. Masalan, suvning 200S dagi issiqlik sig’imi-4200, qayin daraxtniki-1700, havoniki-1010 J/kg K ni tashkil qiladi. Metallarda u kichikdir: alyuminiyniki-880, temirniki-460, misniki-385, qo’rg’oshinniki-130 J/kg K. Solishtirma issiqlik sig’imi temperatura ortishi bilan sekin o’sadi (900S da suvning issiqlik sig’imi 4220J/kg K ni tashkil qiladi) va fazaviy o’zgarishlarda kuchli o’zgaradi: 00S dagi muzning issiqlik sig’imi shu temperaturadagi suvnikidan 2 marta kichik; 1000S da suv bug’ining issiqlik sig’imi 1500J/kg K ga yaqin .
Issiqlik sig’imi jism temperaturasining o’zgarishi qanday sharoitda yuz berayotganiga bog’liq bo’ladi. Agar jism o’lchamlari o’zgarmayotgan bo’lsa, barcha issiqlik ichki energiyaning o’zgarishiga sarflanadi. Bunda o’zgarmas hajmdagi issiqlik sig’imi (Sv haqida gap boradi. O’zgarmas tashqi bosimda issiqlik kengayishi tufayli tashqi kuchlarga qarshi mexanik ish bajariladi hamda u yoki bu temperaturagacha qizdirish uchun ko’proq issiqlik kerak bo’ladi. Shuning uchun ham o’zgarmas bosimdagi issiqlik sig’imi Sr hamma vaqt Sv dan katta bo’ladi. Ideal gazlar uchun Sr-Sv=R (rasmga qarang), bunda R-gaz doimiysi bo’lib, u 8,32 J/mol K ga teng).
Odatda Sr o’lchanadi. Issiqlik sig’imini o’lchashning klassik usuli quyidagicha: issiqlik sig’imi (Sx) o’lchanmoqchi bo’lgan jism muayyan tx temperaturagacha qizdiriladi hamda uni suv yoki issiqlik sig’imi ma’lum bo’lgan boshqa suyuqlik bilan to’ldirilgan t0 boshlang’ich temperaturali kalorimetrga tushiriladi (Ck va Cc-kalorimetr va suyuqlikning sig’imlari). Issiqlik muvozanati o’rnashgandan keyin kalorimetrdagi (t) temperaturani o’lchab, jism issiqlik sig’imini quyidagicha formuladan hisoblash mumkin: 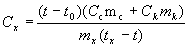 bunda mx, mc va mk-tegishlicha jism, suyuqlik va kalorimetr massalari.
bunda mx, mc va mk-tegishlicha jism, suyuqlik va kalorimetr massalari.
Gazlarning issiqlik sig’imi nazariyasi juda rivojlangan. Odatdagi temperaturalarda isitish asosan gaz molekulalarining ilgarilanma va aylanma harakat energiyalarining o’zgarishiga olib keladi. Bir atomli gazlarning molyar issiqlik sig’imi Sv uchun nazariya 3R/2, ikki atomli va ko’p atomlilar uchun 5R/2 va 3R ni beradi. Juda past temperaturalarda issiqlik sig’imi kvant effektlar tufayli bir oz kichik bo’ladi (Kvant mexanika). Yuqori temperaturalarda tebranma energiya qo’shiladi va ko’p atomli gazlarning issiqlik sig’imi temperatura ko’tarilishi bilan o’sa boradi.
Klassik nazariyaga ko’ra, kristallarning atom issiqlik sig’imi 3R ga teng bo’lib, u Dyulong va Pti empirik qonuniga (1819 yilda fransuz olimlari P.Dyulong va A.Pti tomonidan o’rganilgan) mos keladi. Issiqlik sig’imining kvant nazariyasi yuqori temperaturalarda shunday xulosalarga olib kelsa-da, u temperatura pasayganda issiqlik sig’imining kamayishini ham ko’rsatib berdi. Absolyut nol yaqinida barcha jismlarning issiqlik sig’imi nolga intiladi (termodinamikaning uchinchi qonuni).